电解电压计算器是一款科学工具,用于估算驱动电化学反应(通常称为电解)所需的最低电压。电解是利用电能引发非自发反应的过程。 化学 反应,例如将水分解为氢气和氧气。
这款计算器可帮助化学家、工程师、教育工作者和研究人员确定克服电解装置中热力学和实际障碍所需的电势差。它考虑了标准电极电势、温度、电子转移和 浓度 离子,使用户能够优化他们的电化学实验或工业过程。
电解电压计算器公式
为了计算电解所需的电压, 能斯特 方程以稍微修改的形式使用,以适应完整的电解槽:
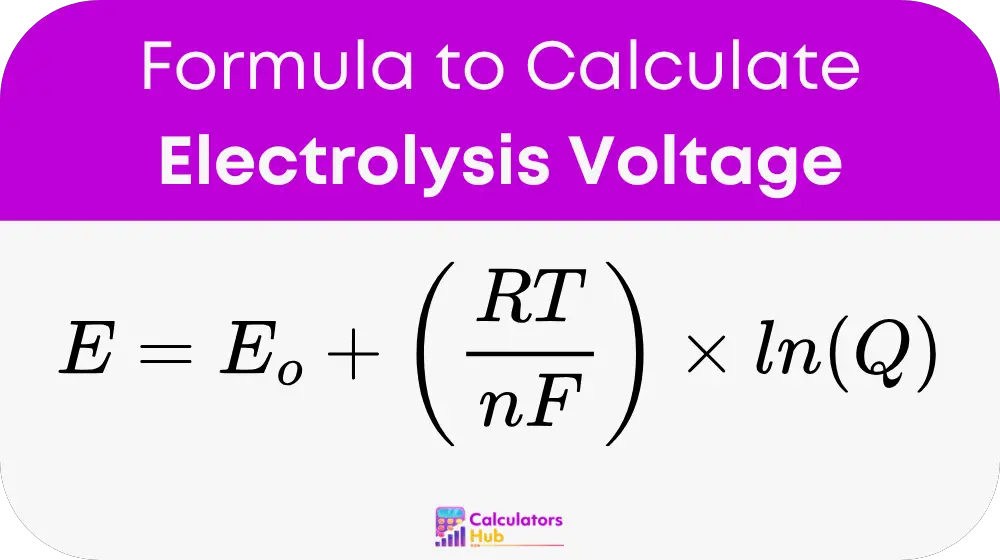
地点:
- E 是电解池电势(单位为伏特,V)
- E₀ 是标准电极电位(单位为伏特,V)
- R 是普适气体常数(8.314 J/mol·K)
- T 是 绝对温度 (单位:开尔文,K)
- n 是电化学反应中转移的电子数
- F 是法拉第常数(96,485 C/mol)
- Q 是反应商,表示产物和反应物浓度的比率
该方程允许根据温度和化学条件调整电压,从而提供比单独的标准电位更准确的估计。
了解组件
- E₀ 标准氧化还原反应的值是已知的,可以在电化学系列表中找到。
- Q 是根据反应物和产物的浓度或分压计算得出的。
- T 必须使用 T(K) = T(°C) + 273.15 将开尔文温度从摄氏度转换为摄氏度。
- n 取决于具体的氧化还原过程。例如,在水电解中, N = 2时 用于生成 H₂。
电解电压计算相关通用术语
下表列出了电解计算中常用的基本术语和定义。理解这些术语和定义有助于用户有效地使用计算器。
| 按揭年数 | 定义 |
|---|---|
| 电解 | 利用电来驱动化学变化或反应的过程 |
| 电极电位 (E₀) | 标准条件下半电池的电压(1 M、25°C、1 atm) |
| 细胞电位 (E) | 完全电解反应所需的实际电压 |
| 反应商(Q) | 任意给定时刻产物与反应物的浓度比 |
| 法拉第常数(F) | 每单位电荷量 痣 电子数(96,485 C/mol) |
| 温度 (T) | 所有电化学方程中必须使用开尔文 |
| 转移电子数(n) | 氧化还原反应中每个反应物分子移动的电子数 |
| 过电位 | 由于效率低下和实际损耗而需要额外的电压 |
这些术语构成了理解如何计算电解电压以及实际系统如何运行的基础。
电解电压计算器示例
让我们通过一个实际的例子来计算水分解为氢和氧的电解电压。
鉴于:
- 总反应的标准电极电位(E₀)= 1.23 V
- 温度 (T) = 298 K (25°C)
- 转移的电子数(n)= 2
- 浓度是标准的,所以 Q = 1
第 1 步:使用公式
E = 1.23 + [(8.314 × 298) / (2 × 96485)] × ln(1)
E = 1.23 + (2477.572 / 192970) × 0 = 1.23 + 0
最终答案:E = 1.23 V
在这种情况下,电解电压保持在标准电位,因为反应商为1,且与标准条件没有偏差。然而,在实际装置中,过电位和效率低下通常会使所需电压升高到1.8-2.0 V左右。
最常见的常见问题解答
电解所需的电压取决于标准电极电位、体系温度、所涉及离子的浓度(通过反应商)以及转移的电子数量。在实际应用中,过电位也起着重要作用。
实际系统存在效率低下的问题,例如电解质电阻、电极表面限制以及副反应。这些因素被视为过电位,需要的实际电压高于理论公式的预测值。
是的,可以通过优化电极材料、提高温度、改善电解质电导率以及保持理想浓度水平来降低过电位。在电极上使用催化剂也有助于降低过电位。