XNUMXμmの波長を持つ 実効電荷計算機 強力なツールとして使用される 原子物理学 および 化学 推定する 有効核電荷 (Z_eff) は、多電子原子中の電子が受けるエネルギーです。Z_eff の値は、他の電子による遮蔽効果を考慮した上で、電子が原子核にどれだけ強く保持されているかを表すのに役立ちます。
この計算機は 化学と原子物理学の計算機 カテゴリ。
Z_effは キー 原子構造、周期的な傾向(イオン化エネルギーや 原子半径)、及び 化学物質 行動。学生、研究者、教育者が原子内で電子がどのように相互作用するかをモデル化し、反応性の傾向をより正確に予測するのに役立ちます。
実効電荷計算の式
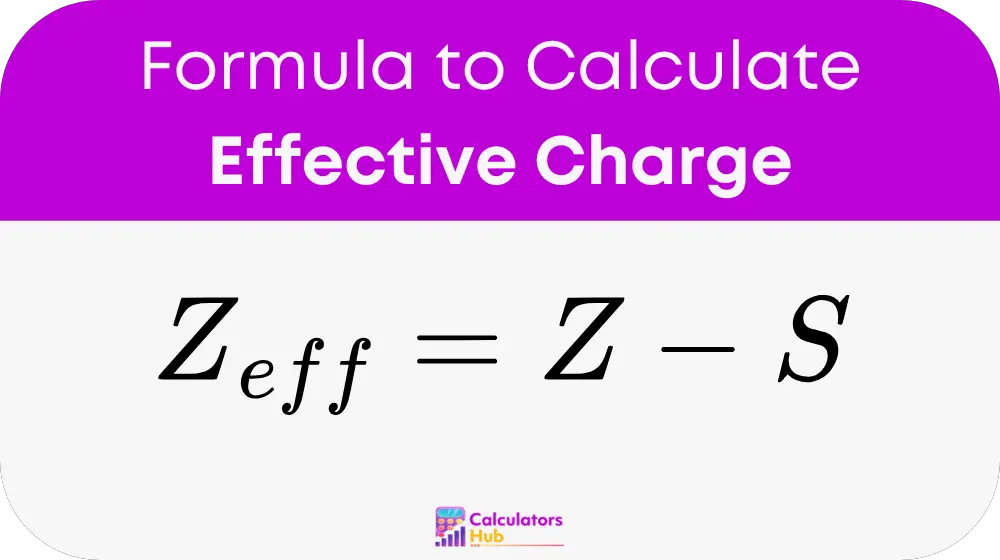
変数の定義:
Z_効率:
有効核電荷(基本電荷単位で測定)。電子遮蔽を考慮した後の電子が感じる正味の正電荷です。
Z:
原子番号。原子核内の陽子の数に等しい。
S:
遮蔽定数は、他のすべての電子からの遮蔽寄与の合計であり、次のように決定されます。 スレーターのルール.
S(遮蔽定数)を計算するためのスレーターの規則:
スレーターの規則は、遮蔽効果を推定する段階的な方法を提供します。
- 電子をセットにグループ化します。
- (1s)、(2s, 2p)、(3s, 3p)、(3d)、(4s, 4p)など。
- 次のシールド値を適用します。
- それぞれの電子について 同じグループ 標的電子として:
→ 0.35 を追加(0.30s グループの場合は 1 を使用) - それぞれの電子について (n−1) レベル(1シェル下):
→ 0.85を加算 - 各レベルの電子ごとに (n−2) またはそれ以下:
→ 1.00を加算 - dブロック電子とfブロック電子の場合:
- 同じグループのすべての電子は0.35を寄与する
- すべての内部電子は1.00に寄与する
- それぞれの電子について 同じグループ 標的電子として:
すべての貢献を合計すると Sから引いて Z 取得するため Z_eff.
実効核電荷の参照表
| 素子 | 原子番号(Z) | 遮蔽定数(S、約) | 有効核電荷(Z_eff) |
|---|---|---|---|
| 水素(H) | 1 | 0.30 | 0.70 |
| ヘリウム(彼) | 2 | 0.30 | 1.70 |
| リチウム(Li、2s電子) | 3 | 1.30 | 1.70 |
| ベリリウム(Be、2s電子) | 4 | 1.95 | 2.05 |
| フッ素(F、2p電子) | 9 | 4.85 | 4.15 |
| ネオン(Ne、2p電子) | 10 | 5.10 | 4.90 |
この表は、よく研究される元素の簡単な値を示しており、ユーザーが 時間 トレンドを分析するときに。
実効料金計算機の例
計算してみましょう 有効核電荷 のために フッ素(F)原子の2p電子.
ステップ1:原子番号(Z)を決定する:
フッ素は Z=9
ステップ2: シールド定数(S)を決定する:
スレーターのルールによれば:
- 同じグループの電子(2s、2p): 4電子 × 0.35 = 1.40
- (n−1)殻の電子数(1s): 2電子 × 0.85 = 1.70
- 合計S = 1.40 + 1.70 = 3.10
ステップ3: 数式を適用する:
Z_eff = 9 − 3.10 = 5.90
結果:
フッ素の2p電子の有効核電荷はおよそ 5.90
最も一般的な FAQ
A: Z_eff は、他の電子からの反発を考慮した上で、電子が原子核にどれだけ強く引き寄せられるかを示します。Z_eff が高いほど、電子を引き寄せる力が強くなり、サイズ、イオン化エネルギー、反応性に影響を与えます。
A: スレーター則は、教育的および概念的な用途に適した近似値を提供します。高精度の結果を得るには量子化学的な手法が用いられますが、スレーター則は一般的な用途でも広く受け入れられています。
A: はい、しかしd軌道とf軌道を扱う際には特別な注意が必要です。遮蔽寄与のルールが若干異なるため、電子を正しくグループ化することが重要です。