Le calculateur Keq est conçu pour fournir un calcul rapide et précis de la constante d'équilibre à partir des concentrations de réactifs et de produits impliqués dans un gravure et découpe réaction. Cet outil est essentiel pour les chimistes qui ont besoin de prédire le résultat de réactions et à des fins pédagogiques où la compréhension de la dynamique de l'équilibre chimique est nécessaire.
Formule du calculateur de Keq
La constante d'équilibre (Keq) est calculée à l'aide de la formule :
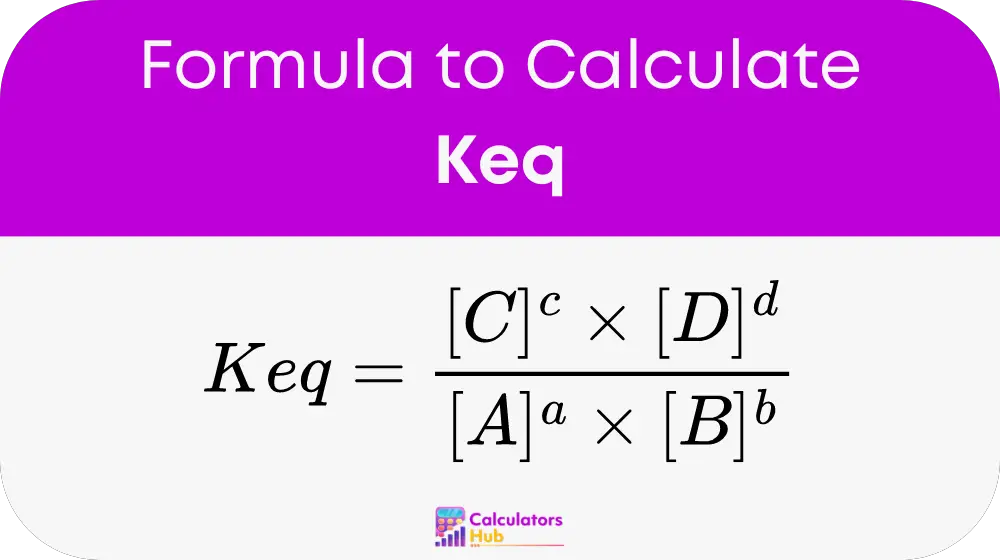
Où :
- A B C D sont les espèces chimiques impliquées dans la réaction.
- a B c d sont les coefficients stœchiométriques de ces espèces.
Cette formule reflète la façon dont les concentrations d’espèces chimiques à l’équilibre influencent la direction et l’étendue de la réaction.
Tableau des Conditions Générales et Facteurs de Conversion
Pour faciliter l'application pratique du calculateur Keq, le tableau suivant répertorie les termes courants et les facteurs de conversion :
| Long | Définition | Exemple |
|---|---|---|
| Concentration | Quantité d'une substance par espace défini | mole/L (Molarité) |
| Coefficient stoechiométrique | Nombre indiquant le rapport dans une équation équilibrée | comme on le voit dans la formule |
| Quotient de réaction | Rapport des concentrations de produits aux concentrations de réactifs avant d'atteindre l'équilibre | Utilisé dans les calculs prédictifs |
Ce tableau sert de référence rapide pour améliorer la compréhension et l'application de la formule Keq sans avoir besoin de calculs détaillés pour chaque scénario.
Exemple de calculateur Keq
Considérons une réaction hypothétique où l'hydrogène gazeux (H2) et l'iode gazeux (I2) réagissent pour former de l'iodure d'hydrogène (HI) :
H2 + I2 -> 2HI
En utilisant des concentrations hypothétiques à l’équilibre :
- [HI] = 0.2 M
- [H2] = 0.1M
- [I2] = 0.1 M
Le Keq serait calculé comme suit :
Keq = ([HI]^2) / ([H2] * [I2]) = (0.2^2) / (0.1 * 0.1) = 4
Cet exemple illustre comment le calculateur Keq simplifie la détermination de la constante d'équilibre, fournissant ainsi un aperçu de la dynamique de la réaction.
FAQ les plus courantes
A1 : Keq fournit une mesure quantitative de la tendance d’une réaction à se terminer ou à s’inverser, essentielle pour prédire et contrôler les processus chimiques.
A2 : Oui, Keq dépend de la température. Les changements de température peuvent déplacer la position d'équilibre, affectant la valeur Keq.