Calculadora de carga efectiva es una poderosa herramienta utilizada en física atómica y química para estimar el carga nuclear efectiva (Z_eff) que experimenta un electrón en un átomo multielectrónico. El valor de Z_eff ayuda a describir la firmeza con la que un electrón se encuentra sujeto al núcleo tras considerar el efecto de apantallamiento causado por otros electrones.
Esta calculadora se incluye en la Calculadoras de química y física atómica .
Z_eff interpreta a un clave papel en la comprensión de la estructura atómica, las tendencias periódicas (como la energía de ionización y radio atómico), o químico Comportamiento. Ayuda a estudiantes, investigadores y educadores a modelar cómo interactúan los electrones dentro de los átomos y a predecir las tendencias de reactividad con mayor precisión.
Fórmula de la calculadora de carga efectiva
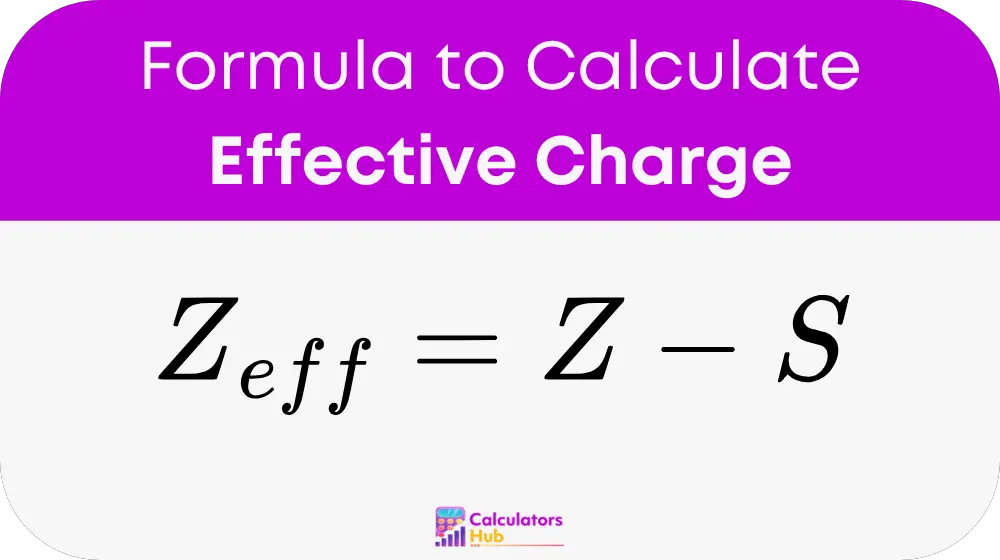
Definiciones de variables:
Z_eff:
Carga nuclear efectiva (medida en unidades de carga elementales), que es la carga neta positiva que siente un electrón después de tener en cuenta el blindaje electrónico.
Z:
Número atómico, que equivale al número de protones en el núcleo del átomo.
S:
Constante de blindaje, que es la suma de las contribuciones de blindaje de todos los demás electrones, determinada utilizando Reglas de Slater.
Reglas de Slater para calcular S (constante de blindaje):
Las reglas de Slater proporcionan un método paso a paso para estimar el efecto de protección.
- Agrupa los electrones en conjuntos:
- (1s), (2s, 2p), (3s, 3p), (3d), (4s, 4p), etc.
- Aplicar estos valores de protección:
- Para cada electrón en el Mismo grupo como electrón objetivo:
→ Agregue 0.35 (use 0.30 si está en el grupo de 1) - Para cada electrón en el (n-1) nivel (una concha más abajo):
→ Añadir 0.85 - Para cada electrón en niveles (n-2) o inferior:
→ Añadir 1.00 - Para los electrones del bloque d y f:
- Todos los electrones del mismo grupo contribuyen con 0.35
- Todos los electrones internos contribuyen con 1.00
- Para cada electrón en el Mismo grupo como electrón objetivo:
Sumar todas las contribuciones para obtener S, y restar de Z para obtener Z_eff.
Tabla de referencia para cargas nucleares efectivas
| Element | Número atómico (Z) | Constante de blindaje (S, aprox.) | Carga nuclear efectiva (Z_eff) |
|---|---|---|---|
| Hidrógeno (H) | 1 | 0.30 | 0.70 |
| Helio (él) | 2 | 0.30 | 1.70 |
| Litio (Li, electrón 2s) | 3 | 1.30 | 1.70 |
| Berilio (Be, electrón 2s) | 4 | 1.95 | 2.05 |
| Flúor (F, electrón 2p) | 9 | 4.85 | 4.15 |
| Neón (Ne, electrón 2p) | 10 | 5.10 | 4.90 |
Esta tabla proporciona valores rápidos para los elementos comúnmente estudiados, lo que ayuda a los usuarios a ahorrar time Al analizar tendencias.
Ejemplo de calculadora de carga efectiva
Calculemos el carga nuclear efectiva para un Electrón 2p en un átomo de flúor (F).
Paso 1: Determinar el número atómico (Z):
El flúor tiene Z=9
Paso 2: Determinar la constante de blindaje (S):
Según las reglas de Slater:
- Electrones del mismo grupo (2s, 2p): 4 electrones × 0.35 = 1.40
- Electrones en la capa (n−1) (1s): 2 electrones × 0.85 = 1.70
- Total S = 1.40 + 1.70 = 3.10
Paso 3: Aplicar la fórmula:
Z_eff = 9 − 3.10 = 5.90
Resultado:
La carga nuclear efectiva de un electrón 2p en el flúor es aproximadamente 5.90
Preguntas frecuentes más comunes
R: Z_eff indica la fuerza con la que un electrón es atraído por el núcleo tras considerar la repulsión de otros electrones. Un Z_eff más alto implica una mayor atracción sobre el electrón, lo que afecta su tamaño, energía de ionización y reactividad.
R: Las Reglas de Slater proporcionan buenas aproximaciones para uso educativo y conceptual. Para obtener resultados de alta precisión, se emplean métodos de química cuántica, pero el método de Slater goza de amplia aceptación para uso general.
R: Sí, pero se requiere especial cuidado al trabajar con orbitales d y f. Las reglas para las contribuciones de apantallamiento varían ligeramente, y es importante agrupar los electrones correctamente.