Der Elektrolyse-Spannungsrechner ist ein wissenschaftliches Werkzeug zur Berechnung der Mindestspannung, die für eine elektrochemische Reaktion, allgemein bekannt als Elektrolyse, erforderlich ist. Elektrolyse ist der Prozess, bei dem elektrische Energie genutzt wird, um eine nicht-spontane Reaktion auszulösen. chemisches Reaktion, wie beispielsweise die Spaltung von Wasser in Wasserstoff und Sauerstoff.
Dieser Rechner hilft Chemikern, Ingenieuren, Pädagogen und Forschern, die erforderliche Potentialdifferenz zu bestimmen, um die thermodynamischen und praktischen Barrieren in einem Elektrolyse-Aufbau zu überwinden. Er berücksichtigt Standardelektrodenpotentiale, Temperatur, Elektronentransfer und Konzentration von Ionen, wodurch Benutzer ihre elektrochemischen Experimente oder industriellen Prozesse optimieren können.
Formel des Elektrolysespannungsrechners
Um die für die Elektrolyse erforderliche Spannung zu berechnen, Nernst Die Gleichung wird in leicht modifizierter Form verwendet, um die vollständige Elektrolysezelle zu berücksichtigen:
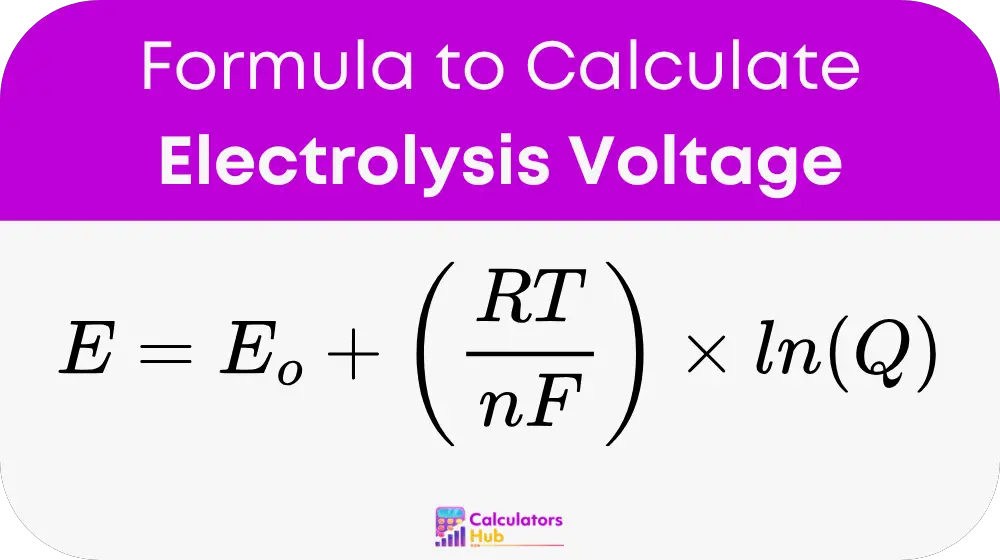
Kennzahlen:
- E ist das Potenzial der Elektrolysezelle (in Volt, V)
- E₀ ist das Standardelektrodenpotential (in Volt, V)
- R ist die universelle Gaskonstante (8.314 J/mol·K)
- T ist das Absolute Temperatur (in Kelvin, K)
- n ist die Anzahl der Elektronen, die bei der elektrochemischen Reaktion übertragen werden
- F ist das Faradaysche Konstante (96,485 C/mol)
- Q ist der Reaktionsquotient, der das Verhältnis der Produkt- und Reaktantenkonzentrationen darstellt
Diese Gleichung ermöglicht die Anpassung der Spannung basierend auf Temperatur und chemischen Bedingungen und liefert eine genauere Schätzung als das Standardpotenzial allein.
Die Komponenten verstehen
- E₀ Werte sind für Standard-Redoxreaktionen bekannt und in Tabellen der elektrochemischen Spannungsreihe verfügbar.
- Q wird aus den Konzentrationen oder Partialdrücken der Reaktanten und Produkte berechnet.
- T in Kelvin muss von Celsius mit T(K) = T(°C) + 273.15 umgerechnet werden.
- n hängt vom spezifischen Redoxprozess ab. Beispielsweise bei der Wasserelektrolyse n = 2 zur H₂-Erzeugung.
Allgemeine Begriffe zur Berechnung der Elektrolysespannung
Die folgende Tabelle enthält wichtige Begriffe und Definitionen, die häufig im Zusammenhang mit Elektrolyseberechnungen verwendet werden. Das Verständnis dieser Begriffe erleichtert die effektive Anwendung des Rechners.
| Bedingungen | Definition |
|---|---|
| Elektrolyse | Ein Prozess, bei dem Elektrizität verwendet wird, um eine chemische Veränderung oder Reaktion anzutreiben |
| Elektrodenpotential (E₀) | Die Spannung einer Halbzelle unter Standardbedingungen (1 M, 25°C, 1 atm) |
| Zellpotential (E) | Die tatsächliche Spannung, die für die vollständige Elektrolysereaktion erforderlich ist |
| Reaktionsquotient (Q) | Das Verhältnis der Konzentrationen von Produkten zu Reaktanten zu einem bestimmten Zeitpunkt |
| Faraday-Konstante (F) | Die Menge an elektrischer Ladung pro Maulwurf von Elektronen (96,485 C/mol) |
| Temperatur (T) | Muss in allen elektrochemischen Gleichungen in Kelvin verwendet werden |
| Übertragene Elektronen (n) | Die Anzahl der Elektronen, die pro Molekül des Reaktanten in einer Redoxreaktion bewegt werden |
| Überpotential | Zusätzliche Spannung aufgrund von Ineffizienzen und realen Verlusten erforderlich |
Diese Begriffe bilden die Grundlage für das Verständnis, wie die Spannung bei der Elektrolyse berechnet wird und wie sich praktische Systeme verhalten.
Beispiel für einen Elektrolyse-Spannungsrechner
Sehen wir uns ein praktisches Beispiel zur Berechnung der Elektrolysespannung für die Zerlegung von Wasser in Wasserstoff und Sauerstoff an.
Gegeben:
- Standardelektrodenpotential für die Gesamtreaktion (E₀) = 1.23 V
- Temperatur (T) = 298 K (25°C)
- Anzahl der übertragenen Elektronen (n) = 2
- Konzentrationen sind Standard, also Q = 1
Schritt 1: Verwenden Sie die Formel
E = 1.23 + [(8.314 × 298) / (2 × 96485)] × ln(1)
E = 1.23 + (2477.572 / 192970) × 0 = 1.23 + 0
Endgültige Antwort: E = 1.23 V
In diesem Fall bleibt die Elektrolysespannung auf dem Standardpotential, da der Reaktionsquotient 1 ist und keine Abweichungen von den Standardbedingungen vorliegen. In realen Aufbauten erhöhen Überpotential und Ineffizienzen die erforderliche Spannung jedoch üblicherweise auf etwa 1.8–2.0 V.
Die häufigsten FAQs
Die für die Elektrolyse erforderliche Spannung hängt vom Standardelektrodenpotential, der Systemtemperatur, der Konzentration der beteiligten Ionen (über den Reaktionsquotienten) und der Anzahl der übertragenen Elektronen ab. In der Praxis spielt auch die Überspannung eine wichtige Rolle.
Reale Systeme weisen Ineffizienzen wie Elektrolytwiderstand, begrenzte Elektrodenoberflächen und Nebenreaktionen auf. Diese werden als Überspannungen berücksichtigt, die eine höhere tatsächliche Spannung erfordern als in der theoretischen Formel vorhergesagt.
Ja, die Überspannung kann durch Optimierung des Elektrodenmaterials, Temperaturerhöhung, Verbesserung der Elektrolytleitfähigkeit und Aufrechterhaltung optimaler Konzentrationsniveaus gesenkt werden. Der Einsatz von Katalysatoren an den Elektroden trägt ebenfalls zur Reduzierung der Überspannung bei.